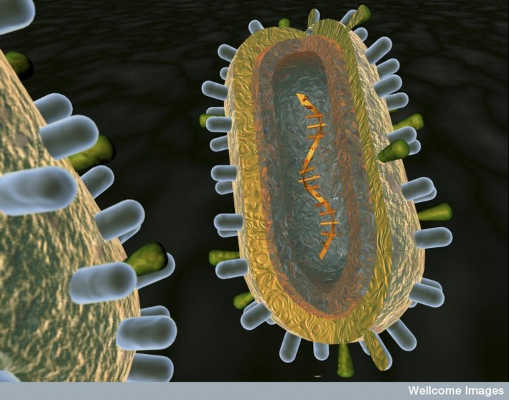
 En kunstneres overføring av virusets anatomi. Anna Tanczos / Wellcome Images, CC BY-NC-ND
En kunstneres overføring av virusets anatomi. Anna Tanczos / Wellcome Images, CC BY-NC-ND
Ingen ønsker å få influensa, og den beste forsvarslinjen er sesonginfluensa vaksinen. Men å produsere et effektivt årlig influensaslag er avhengig av å forutsi hvilke influensastammer som mest sannsynlig vil infisere befolkningen i en gitt sesong. Det krever koordinering av flere helsesentre over hele verden da viruset reiser fra region til region. Når epidemiologer bosetter seg på målgrensestammer, skiftes vaksineproduksjonen til høyt utstyr; det tar omtrent seks måneder å generere mer enn 150 millioner injeksjonsdoser nødvendig for den amerikanske befolkningen.
Hvor godt virker den årlige influensavaksinen?
Å produsere et effektivt årlig influensaslag er avhengig av å forutsi hvilke fluestammer som mest sannsynlig vil infisere befolkningen i en gitt sesong. CDC gjennomfører observasjonsstudier hvert år for å beregne "vaksineffektivitet" for det årets skudd.
Feil eller ufullstendig epidemiologisk prognoser kan få store konsekvenser. I 2009, mens produsenter, inkludert MedImmune og Sanofi Pasteur, var å forberede vaksiner mot forventede stammer, an ytterligere influensastamme, H1N1, dukket opp. Den forberedte vaksinen beskytter ikke mot denne uventede belastningen, noe som forårsaker verdensomspennende panikk og over 18,000-bekreftede dødsfall - sannsynligvis bare en brøkdel av det sanne tallet, anslått å overstige 150,000. Bedre sent enn aldri, ble en vaksine til slutt produsert mot H1N1, som krever et andre influensaslag det året.
Gitt at influensa har forårsaket flertallet av pandemier i løpet av de siste 100 årene - inkludert 1918 influensa som resulterte i så mange som 50 millioner dødsfall - Vi er igjen med spørsmålet: Kan forskere produsere en "universell" vaksine som er i stand til å beskytte mot ulike influensastammer, en som ikke krever årlige spådommer av epidemiologer og et årlig skudd for deg?
Vaksiner fører immunforsvaret til å kjempe
Ved 18th century, og uten tvil mye tidligere i historien, var det kjent at a Overlevende av kopper ville ikke komme ned med det igjen ved påfølgende eksponering. På en eller annen måte fikk infeksjon immunitet mot sykdommen. Og folk anerkjente at melkmaids som kom i kontakt med kopox-ridet storfe også ville være beskyttet mot kopper.
I slutten av 1700s, bonde Benjamin Jesty inokulerte sin familie med kofferter, immuniserer dem effektivt mot kopper, til tross for fremtidig eksponering. lege Edward Jenner så katapultet menneskeheten til en ny alder av immunologi da han utlånte vitenskapelig troverdighet til prosedyren.
Så hvis en inokulasjon av kofferter eller en eksponering for (og overlevelse av) kopper gir en tiårsverdig eller til og med livslang immunitet, hvorfor oppfordres enkeltpersoner til å motta influensavaccinen hvert år?
Svaret ligger i hvor raskt influensavirus 'anatomi endres. Hvert virus består av et grovt sfærisk membraninnkapsling, som konstant mutererer genetisk materiale. Denne membranen er peppered med to typer "pigger": hemagglutinin, eller HA, og neuraminidase, eller NA, hver bestående av en stamme og et hode. HA og NA hjelper viruset med infeksjon ved å binde til vertsceller, og formidle virusets tilgang til cellen og til slutt utgangen.
Vaksiner fremkaller vanligvis antistoffer som retter seg mot disse to molekylene. Når det er injisert, kommer en persons immunsystem til å fungere. Spesialiserte celler samler vaksinmolekylene som inntrengere; andre celler genererer deretter antistoffer som vil gjenkjenne de fremmede molekylene. Neste gang de samme inntrengerne dukker opp - enten i form av det samme vaksinet eller virusstammen det etterliknes - registrerer kroppens immunceller dem og bekjemper dem, for å hindre infeksjon.
For vaksinutviklere er en frustrerende egenskap av influensas muterende genom, hvor raskt HA og NA forandrer seg. Disse konstante endringene er det som sender dem tilbake til tegnebrettet for nye vaksiner hver influensasong.
Ulike metoder for å designe en vaksine
Voksenvaccinen var den første som brukte det "empiriske paradigmet" av vaksinologi - den samme strategien vi i stor grad bruker i dag. Den er avhengig av en prøve-og-feil-tilnærming for å etterligne immuniteten indusert av naturlig infeksjon.
Med andre ord tror vaksineutviklere at kroppen vil montere en antistoffrespons på noe i inokuleringen. Men de fokuserer ikke på hvilken spesifikk patch av viruset som forårsaker en immunrespons. Det spiller ingen rolle om det er en reaksjon på en liten patch av HA som for eksempel mange stammer deler. Ved bruk av et helt virus som utgangsmateriale, er det mulig å få mange forskjellige antistoffer som gjenkjenner mange forskjellige deler av viruset som brukes i vaksinen.
Den sesongbaserte influensafoten passer generelt til denne empiriske tilnærmingen. Hvert år vurderer epidemiologer hvilke influensastammer som mest sannsynlig vil infisere populasjoner, vanligvis settes på tre eller fire. Forskere demper eller inaktiverer disse stammene, slik at de kan fungere som etterligninger i det årets influensavaksine uten å gi mottakerne fullblåst influensa. Håpet er at en persons immunsystem vil reagere på vaksinen ved å skape antistoffer som retter seg mot disse stammene; da når han eller hun kommer i kontakt med influensa, vil antistoffene vente på å nøytralisere disse stammene.
Men det er en annen måte å designe en vaksine på. Det kalles rasjonell design og representerer et potensielt paradigmeskift i vaksinologi.
Målet er å designe noe molekyl - eller "immunogen" - som kan føre til at effektive antistoffer blir produsert uten å kreve eksponering for viruset. I forhold til dagens vaksiner kan det utviklede immunogen til og med tillate mer spesifikke responser, noe som betyr at immunresponsen retter seg mot bestemte deler av viruset, og større bredde, noe som betyr at det kan målrette flere stammer eller til og med relaterte virus.
Denne strategien arbeider for å målrette mot bestemte epitoper, eller patcher av viruset. Siden antistoffer virker ved å gjenkjenne strukturer, ønsker designerne å understreke immunsystemets strukturelle egenskaper ved immunsystemet. Deretter kan forskere forsøke å designe kandidatvacciner med de strukturer i håp om at de vil provosere immunsystemet for å produsere relevante antistoffer. Denne banen kan la dem sette sammen en vaksine som fremkaller en mer effektiv og effektiv immunrespons enn det som er mulig med den tradisjonelle prøve-og-feil-metoden.
Lovende forsprang har blitt gjort i Vaksinasjonsdesign for respiratorisk syncytialvirus ved hjelp av dette nye rasjonelle paradigmet, men det er fortsatt innsats for å bruke denne tilnærmingen til influensa.
Mot en universell influensavaksine
I de senere år har forskere isolert en rekke potente, infleunza-nøytraliserende antistoffer produsert i kroppene våre. Mens antistoffresponsen mot influensa er primært rettet mot hodet til HA spike, flere har blitt funnet det mål HAs stamme. Siden stammen er mer konstant over virale stammer enn hodet, kan dette være influensas Achilles 'hæl, og antistoffer som retter seg mot denne regionen kan være en god mal for vaksineutforming.
Forskere forfølger en rekke tilnærminger som kan føre til at kroppen produserer disse antistoffene av interesse før de blir smittet. En strategi, kjent som nanopartikler, innebærer å designe et molekyl som inkorporerer en del av viruset. I laboratoriet kan forskere feste en kombinasjon av HA og NA partikler på utsiden av en sfærisk nanopartikkel som i seg selv er i stand til å forårsake en immunrespons. Når det injiseres som en del av en vaksine, kan immunsystemet "se" disse molekylene, og med flaks produsere antistoffer mot dem.
Et av de store spørsmålene som må besvares er hva som skal vises på utsiden av disse nanopartikler. Noen strategier viser ulike versjoner av fulle HA-molekyler, mens andre bare inneholder stammer. Mens flere data på mennesker må samles for å validere disse tilnærmingene, er dataene fra dyreforsøk ved bruk av Stam-only immunogener er oppmuntrende.
Med dagens teknologi, kan det aldri være et "en og ferdig" influensa-skudd. Og epidemiologisk overvåking vil alltid være nødvendig. Imidlertid er det ikke utænkelig at vi kan flytte fra en en gang i året til en en gang i hvert 10-år, og vi kan være innenfor bare noen få år med å være der.
![]()
Om forfatteren
Ian Setliff, Ph.D. Student, program i kjemisk og fysisk biologi, Vanderbilt vaksinesenter, Vanderbilt University og Amyn Murji, Ph.D. Student, Institutt for mikrobiologi og immunologi, Vanderbilt Vaccinesenter, Vanderbilt University
Denne artikkelen ble opprinnelig publisert på Den Conversation. Les opprinnelige artikkelen.
Relaterte bøker:
at InnerSelf Market og Amazon






















