
Illustrasjon av McCall Sarrett
Enten det går glemt 20 år i livet ditt eller har samme samtale hvert femte minutt bare for å glemme det hver gang, kan minnetesynkning ta en stor avgift på hverdagen. Det kan være en av de mest forvirrende aspektene av nevrogenerasjon og er et viktig symptom på demens.
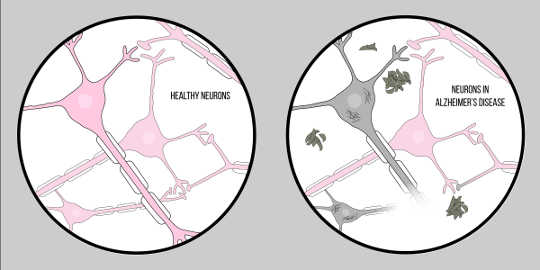
Alzheimers sykdom, også kjent som AD, er den vanligste formen for demens, preget av kognitive problemer og tap av hukommelse. Det er for øyeblikket ingen offisiell klinisk teknikk for å diagnostisere AD, annet enn en obduksjon. Imidlertid er det to karakteristiske trekk ved hjernevæv av Alzheimers sykdomspasienter: amyloid beta (EN?) plakk og neurofibrillære tangles, som begge har gitt en betydelig mengde innsikt i patologien til neurodegenerasjon.
"Neurofibrillære tangles oppstår fra en defekt i proteiner kalt tau-proteiner."
EN? er et protein som er et resultat av proteolyse of Amyloid Precursor Protein (APP). Dette betyr at APP kuttes i mindre fragmenter, hvorav ett er A? fragment. APP kuttes i disse bitene av enzymer kalt sekretaser, hvis primære rolle er å spalte disse proteinene. Det finnes ulike sekretaser, men det er en som er viktig for Alzheimers patologi – gammasekretase. Gammasekretase produserer en spesiell form for A?: A?-42, den giftigste formen av proteinet. Når de er brutt opp, begynner disse proteinfragmentene å samle seg i rommet utenfor cellene. Nøkkelen til toksisiteten til disse proteinene er at de er karakteristisk "klebrige", så de begynner å danne aggregater. Disse aggregatene fortsetter å utvikle seg, og snart er disse amyloid beta-plakkene overalt, noe som i stor grad svekker neuronal funksjon.
 Figur av McCall Sarrett
Figur av McCall Sarrett
Denne virkningen av A? på nevrologisk funksjon har ført til Amyloid hypotesen, en velkjent teori som foreslår en forklaring på nevrogenerasjonen i Alzheimers.
Nå, for den andre nøkkelegenskapen: neurofibrillære tangles. Neurofibrillære tangles oppstår fra en defekt i proteiner som kalles tau-proteiner. Tau-proteiner tjener som en bro mellom strukturer kalt mikrotubuli i cellen. Mikrotubuli støtter molekyler som gir form og struktur til cellene, spesielt, axoner. Tau-proteiner hjelper disse mikrotubuliene til å gi strukturen til axonene. Men i tilfelle av Alzheimers sykdomEn neurodegenerativ sykdom kjennetegnet ved nevronetab i ..., tau-proteiner separerer og akkumuleres i cellelegemet, ellers kjent som soma. Dette fører til degenerasjon av axonene, noe som gjør det enda vanskeligere for nevroner å kommunisere. Denne vanskeligheten i nevronkommunikasjon ligner effekten av amyloid beta; Det er imidlertid viktig å merke seg at disse tanglene varierer sterkt fra plakkene som er diskutert tidligere ved at de påvirker kommunikasjon fra innsiden av cellen i motsetning til utenfor.
"Forskere er fortsatt usikre på den nøyaktige mekanismen som er ansvarlig for Alzheimers patologi."
Selv om begge er ekstremt innflytelsesrike, A? og tau er ikke de eneste relevante faktorene når det gjelder patologien til Alzheimers. Studier har antydet at Apolipoprotein E (APOE) gen kan være like innflytelsesrik som A?. Det er tre hovedvarianter som koder for proteiner: ApoE2, ApoE3 og ApoE4. ApoE4 har vist seg å korrelere med en reduksjon i synaptisk beskjæring, mens ApoE2 resulterer i en økning. Begge former påvirker astrocytter (viktig glialceller i nervesystemet) og er korrelert med deres fagfaktocytose, prosessen hvor astrocytterStjerneformede glialceller som har en rekke funksjoner, inklusiv ... bryter opp cellulært materiale. Hver ApoE-variant påvirker denne frekvensen av fagocytose, ApoE2, noe som resulterer i en økning, og ApoE4, en reduksjon. Dette antyder at astrocytene kan være mindre i stand til å "rydde opp" ruskene som flyter rundt i cellen når det korreleres med ApoE4. Når disse plakkene oppbygges, kan ApoE4-genotypen dermed forhindre utryddelse av disse aggregatene, noe som bidrar til degenerasjon.
Amyloid beta, tau og ulike gener arbeider sammen for å forårsake et stort kommunikasjonsproblem mellom celler, som i hovedsak er sykdommen vi kjenner som Alzheimers. Slike neurodegenerasjon er mest vanlig i områder av hjernen som er forbundet med læring og minne, men til slutt sprer seg over hele hjernen. Med denne mangelen på kommunikasjon kommer et tap av synapses, og til slutt, en nedgang i hjernemateriell. Således er det normalt å se redusert hjernevev på en MRMagnetic resonance imaging, en teknikk for å vise stru ... som sykdommen utvikler, og avslører at Alzheimers bokstavelig talt krymper hjernen. Våre nåværende modeller for læring og minne sier at synapsene spiller en nøkkelrolle i disse prosessene, og gir en mulig forklaring på hvordan denne patologien korrelerer med de store symptomene på AD, som for eksempel tap av minne.
Forskere er fortsatt usikre på den nøyaktige mekanismen som er ansvarlig for Alzheimers patologi. Mange innovative metoder har blitt undersøkt i et forsøk på å få ytterligere kjennskap til dette patologiske punktet, en er cerebrospinalvæske (CSF) biomarkører.
nivåer av A? og tau kan måles i CSF gjennom en prosedyre som kalles en lumbalpunksjon, som samler opp cerebrospinalvæske. Økte nivåer av tau og reduserte nivåer av A? ses hos pasienter med Alzheimers sykdom. Dette er et resultat av A? ansamlinger i hjernen, som igjen resulterer i en redusert konsentrasjon i CSF. Disse dataene antyder at leger og forskere i fremtiden kan være i stand til å forutsi den kognitive tilstanden til en pasient ved å undersøke proteinnivåer i CSF.
For tiden er det ingen definitiv kur for Alzheimers sykdom. Likevel gir økende kunnskap om de involverte patologiske proteiner, tilhørende gener og pågående vitenskapelig forskning håp om en effektiv behandling i fremtiden.
Hvilken gjennombrudd tror du er nødvendig for medisin for å få behandling for Alzheimers? Gi oss beskjed i kommentarene!
Denne artikkelen opprinnelig dukket opp på Å vite nevroner?
Om forfatteren
Khayla Black er en freshman ved New York University Shanghai planlegger å erklære en major i neuropsykologi med en minor i datavitenskap med en konsentrasjon i kunstig intelligens. I fremtiden håper hun å skaffe seg en MD / PhD og bli en nevrologer som studerer molekylære aspekter ved læring og minne. I fritiden trives Khayla med MYELIN-initiativet innen IYNA, samt leser noe nevrovitenskapsrelatert materiale. Utenfor å studere nevrovitenskap, trives hun, underviser på lokale grunnskoler, løser matteproblemer og drikker enorme mengder kaffe.
Relaterte bøker
at InnerSelf Market og Amazon
Referanser
Lacor, PN, Buniel, MC, Furlow, PW, Clemente, AS, Velasco, PT, Wood, M., . . . Klein, WL (2007, 24. januar). EN? Oligomer-induserte aberrasjoner i Synapse Sammensetning, form og tetthet Gi en molekylær grunnlag for tap av tilkobling i Alzheimers sykdom. Innhentet fra http://www.jneurosci.org/content/27/4/796
Murphy, MP og LeVine, H. (2010). Alzheimers sykdom og ?-amyloidpeptidet. Journal of Alzheimers Disease?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ, & Wong, PC (2011). Amyloid Precursor Protein Processing and Alzheimers Disease. Årlig gjennomgang av nevrovitenskap, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, ... Barres, BA (2016). Novell allelavhengig rolle for APOE ved å kontrollere frekvensen av synapseForbindelser mellom nevroner hvor et signal overføres fra på ... beskjæring av astrocytter. Foredrag av Nasjonalt akademi for vitenskap i USA, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, 19. august). Amyloid? og APP som biomarkører for Alzheimers sykdom. Innhentet fra https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























