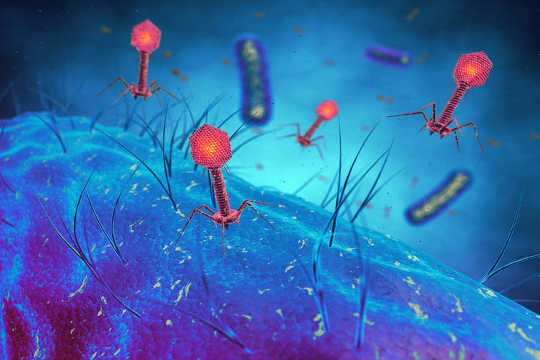
 Bakteriofagvirus som smitter bakterieceller, bakterievirus. fra www.shutterstock.com
Bakteriofagvirus som smitter bakterieceller, bakterievirus. fra www.shutterstock.com
I dag er det vitenskapelige samfunnet forferdet på utsiktene til genredigering for å skape "Designer" mennesker. Genredigering kan ha større konsekvens enn klimaendringer, eller til og med konsekvensene av frigjøring av atomets energi.
CRISPR er et akronym for Clustered regelmessig interspaced Short Palindromic Repeats. Dette er immunforsvaret som bakterier utviklet for å beskytte seg mot infeksjoner av bakteriofager - den mest omfattende livsformen på planeten.
Mindre enn noe kjent livsform
Bakteriofager ble oppdaget i Paris by Felix d'Hérelle på Pasteur-instituttet i 1917. Han studerte en delmengde av pasienter som spontant gjenvunnet fra dysenteri. D'Hérelle foreslo at en antimikrobi mindre enn noe kjent livsform hadde drept bakteriene i infiserte pasienter. Han demonstrerte endelige eksistensen av denne nye livsformen, og kalte dem bakteriofager: virus som angriper bakterier.
Bakteriofagen har blitt studert intensivt: dens skjønnhet ble avslørt med elektronmikroskopet og dens genom var den første livsformen sekvensert.
Reagerer på et bakteriofagangrep
I 2007 samarbeidet Rodolphe Barrangou og Philippe Horvath fra matproduksjonsselskapet Danisco med Sylvain Moineau fra Laval University for å løse et langvarig problem i yoghurtproduksjon. De spurte: Hvorfor var bakterier som var essensielle for produksjon av yoghurt og ost utsatt for bakteriofag angrep, og hvordan kunne dette forhindres?
Barrangou, Horvath og Moineau laget forbløffende funn at bakteriene faktisk hadde et immunsystem.
CRISPR: Ervervet bakterielle immunsystemer.
{youtube}yW0yA3qoH9A{/youtube}
Etter et innledende bakteriofagangrep, ville et lite antall overlevende bakterier gjenkjenne DNA-en av de nylig angripende bakteriofager. De overlevende bakteriene vil da montere en immunrespons som fører til bakteriofagens død. Bakteriene som overlevde et fagangrep ville legge inn et fragment av bakteriofag DNA i sitt bakteriegenom for å tjene som et "minne" av infeksjonen.
Mål og skille
Barrangou, Horvath og Moineau da oppdaget hvordan de invaderende bakteriofager ble eliminert. Ved anerkjennelse av den nyinvigende bakteriofagen ville bakteriene målrette og separere DNA fra den invaderende bakteriofagen.
Fond de recherche de Québec: CRISPR-Cas9: L'origine de la découverte | Sylvain Moineau.
{youtube}Bz0aN5qEkyw{/youtube}
Biologer Jennifer Doudna og Emmanuelle Charpentier oppdaget videre at "guider" hadde utviklet seg i det bakterielle immunsystemet. En hvilken som helst bakteriofag hvis DNA korresponderer med det oppkjøpte minnesfragmentet fra en tidligere infeksjon, vil bli anerkjent og kuttet av et "styrt" elimineringsmaskin. Sammen er det bakterielle immunforsvaret som omfatter minnefragmenter av bakteriofag DNA og bakteriell responsmaskinen kjent som CRISPR-Cas9-systemet.
Kommersiell utnyttelse av funnene fulgte. Doudna, Charpentier og andre innså at dette nye biologiske systemet kunne utnyttes for å redigere gener i ethvert livsform.
Bozeman Science: Hva er CRISPR?
{youtube}MnYppmstxIs{/youtube}
CRISPR-Cas9-systemet er ikke det første genredigeringssystemet som skal oppdages. Den sen biokjemikeren Michael Smith, mens ved University of British Columbia, ble tildelt en Nobelpris i 1993 for oppdagelsen av et kjemisk middel for genredigering med applikasjoner som er relevante for kreft og andre sykdommer.
UBC Science: The Legacy of Dr. Michael Smith.
{youtube}khYP1dN5nRg{/youtube}
Bakteriofager som en potensiell løsning
D'Hérelle observert at samme bakteriofag isolert fra pasienter som gjenoppretter fra dysenteri, kan brukes til å beskytte kaniner mot en ellers dødelig infeksjon. Kommer før oppdagelsen av antibiotika, inspirerte d'Hérelles funn Sinclair Lewis å inneholde bakteriofagbehandling av mennesker i hans Pulitzer-prisvinnende roman Arrowsmith.
En av største samlinger av bakteriofager globalt er ved Laval University. Sylvain Moineau er kurator, og samlingen er oppkalt etter Felix d'Hérelle.
Håpet er nå at bakteriofagterapi kan betraktes som en potensiell løsning på antibiotikaresistens. Imidlertid er eventuelle forventninger til fagbehandling dwarfed av den nåværende utnyttelsen av kommersielle fordeler av CRISPR-Cas9-systemet.
I dag, konsekvenser Å åpne en Pandoras boks er over oss. Anvendelsen av CRISPR-Cas9-systemet for å generere designer mennesker gjennom "germ-line" -generering av høstede humane egg vil skape permanente forandringer som fortsetter gjennom suksessive generasjoner, og frykten over disse handlingene kan være sammenlignbar med konsekvenser av atomkrigsforsikring og klimaendringer.
Men det er andre potensielle bruksområder av "non-germline" CRISPR-Cas9, som genredigering av sykdom. Dette har nylig blitt vellykket for muskeldystrofi hos hunder. Akin til myten om Pandoras boks, kan pessimismen om "germ-line" genredigering bli kompensert av håp om fremtidig nytte for menneskeheten.
{youtube}lXmHA-XySmk{/youtube}
Om forfatteren
John Bergeron, Emeritus Robert Reford Professor og professor i medisin ved McGill, McGill University. John Bergeron anerkjenner takknemlig Kathleen Dickson som medforfatter.![]()
Denne artikkelen er publisert fra Den Conversation under en Creative Commons-lisens. Les opprinnelige artikkelen.
Relaterte bøker
at InnerSelf Market og Amazon